进口药品再注册审批事项服务指南
|
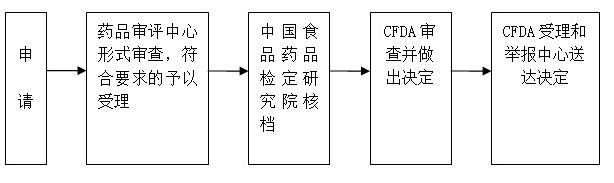
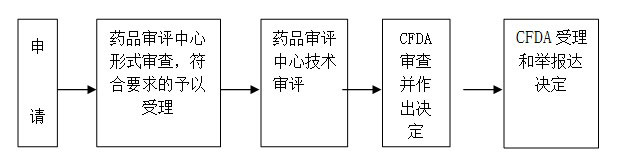
一、适用范围 本指南适用于进口药品再注册的申请和办理。 二、项目信息 (一)项目名称:进口药品(包括进口药品、进口药材、临时进口药品)注册审批 (二)子项名称: 一、适用范围 本指南适用于进口药品再注册的申请和办理。 二、项目信息 (一)项目名称:进口药品(包括进口药品、进口药材、临时进口药品)注册审批 (二)子项名称:进口药品有效期满后的再注册核准 (三)项目编码:30024 三、办理依据 《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《药品注册管理办法》、《关于进口药品再注册有关事项的公告》(国食药监注[2009]18号)。 四、受理机构 国家食品药品监督管理总局药品审评中心 五、决定机构 国家食品药品监督管理总局 六、审批数量 无数量限制 七、办事条件 申请人条件:药品注册申请人,是指提出药品注册申请并承担相应法律责任的机构。境外申请人办理进口药品注册,应当由其驻中国境内的办事机构或者由其委托的中国境内代理机构办理。 八、申请材料 (一)申请材料清单 1.《药品再注册申请表》 2.证明性文件: ⑴《进口药品注册证》复印件及国家食品药品监督管理总局批准有关补充申请批件的复印件; ⑵药品生产国家或者地区药品管理机构出具的允许该药品上市销售及该药品生产企业符合药品生产质量管理规范的证明文件、公证文书及其中文译本; ⑶药品生产国家或者地区药品管理机构允许药品进行变更的证明文件、公证文书及其中文译本; ⑷由境外制药厂商常驻中国代表机构办理注册事务的,应当提供《外国企业常驻中国代表机构登记证》复印件; ⑸境外制药厂商委托中国代理机构代理申报的,应当提供委托文书、公证文书及其中文译本,以及中国代理机构的《营业执照》复印件。 3.五年内在中国进口、销售情况的总结报告,对于不合格情况应当作出说明。 4.药品进口销售五年来临床使用及不良反应情况的总结报告。 5.首次申请再注册药品有下列情形之一的,应当提供相应资料或者说明: ⑴需要进行IV期临床试验的应当提供IV期临床试验总结报告; ⑵药品批准证明文件或者再注册批准文件中要求继续完成工作的,应当提供工作总结报告,并附相应资料。 6.提供药品处方、生产工艺、药品标准和检验方法。凡药品处方、生产工艺、药品标准和检验方法与上次注册内容有改变的,应当指出具体改变内容,并提供批准证明文件。 7.生产药品制剂所用原料药的来源。改变原料药来源的,应当提供批准证明文件。 8.在中国市场销售药品最小销售单元的包装、标签和说明书实样。 9.药品生产国家或者地区药品管理机构批准的现行原文说明书及其中文译本。 (二)申报资料的一般要求 1.申报资料首页为申报资料项目目录,目录中申请资料项目按《药品注册管理办法》(国家食品药品监督管理局令第28号)附件5的顺序排列。每项资料封面上注明:药品名称、资料项目编号、项目名称、申请机构联系人姓名,电话,地址。 2.申报资料用A4纸打印,内容完整、清楚,不得涂改。资料应完整、规范,数据必须真实、可靠。 3.资料按套装如档案袋,档案袋封面注明:申请分类、注册分类、药品名称、本袋所属第X套第X袋每套共X袋、原件/复印件 联系人、联系电话、申请注册代理机构名称。 4.请报送2套完整申请资料(其中1套为原件,1套为复印件),申请表2份(1份为原件,1份为复印件)分别装入各套资料中。 5.请在www.cfda.gov.cn下载药品注册申请表报盘程序制作申请表,在邮寄或递交申请资料时将申请表的电子版发送至slzx@sfda.gov.cn邮箱中。 6.外文资料应当按要求提供中文译本。 (三)申报资料的具体要求 1.《药品再注册申请表》: ⑴从国家食品药品监督管理总局网站(www.cfda.gov.cn)下载药品注册申请表报盘程序,按要求填写后打印并保存,要有外国公司的签字及国内代理机构盖章签字。 ⑵填写的药品名称,规格,有效期,进口药品公司及生产厂家等信息如无变更应与所提供的《进口药品注册证》或者《进口药品注册证》复印件及国家食品药品监督管理总局批准的补充申请批件的复印件上相应信息是否一致。 ⑶申请表上第17项应详细注明补充申请内容,具体填写末次批准注册至本次提出再注册申请期间提出的补充申请及其批准情况。如符合《关于进口药品再注册有关事项的公告》第二条第一项规定情形的申请再注册核档程序,申请人应当在《药品再注册申请表》的“其他特别申明事项”中申明相应变更事项并注明“本申请符合再注册申请核档程序的要求”。 ⑷再注册申请前已申报补充申请,国家食品药品监督管理总局尚未完成审评审批工作的,申请人应当在《药品再注册申请表》中列明相关情况,并提交相关补充申请的受理通知单复印件,国家食品药品监督管理总局依据原批准内容进行再注册受理和审批工作。 2.证明性文件: ⑴应提供该品种药品生产国家或者地区药品管理机构出具的允许该药品上市销售及该药品生产企业符合药品生产质量管理规范的证明文件、公证文书及其中文译本,要求同注册申请。 ⑵如再注册合并补充申请,需同时提交药品生产国家或者地区药品管理机构允许药品进行变更的证明文件、公证文书及其中文译本。 1)格式应当符合中药、天然药物、化学药品、生物制品申报资料项目中对有关证明性文件的要求。 2)除变更药品规格、改变产地、改变制药厂商和注册地址名称外,生产国家或者地区药品管理机构不能出具有关证明文件的,可以依据当地法律法规的规定做出说明。 ⑶应提供《外国企业常驻中国代表机构登记证》复印件或注册代理机构的《法人营业执照》复印件,如注册代理机构发生变更,还应提供境外制药厂商解除原委托代理注册关系的文书原件,并在当地公证机构公证。 3.按照《药品注册管理办法》附件5的要求附齐其它资料。 4.属于下列情形的进口药品再注册,申请人可以申请再注册核档程序: ⑴再注册申请时,其药品处方、生产工艺、质量标准、原辅料来源、直接接触药品的包装材料、说明书和包装标签等与上次注册时未发生任何变更的;或已发生变更,但该变更的补充申请已经按照《药品注册管理办法》的规定,得到国家食品药品监督管理总局批准或者已经备案完毕的; ⑵公司和生产厂的名称和地址名称变更、药品名称变更等无技术审评内容的; ⑶增加或者完善说明书安全性内容的; ⑷缩短药品有效期的; ⑸其他由国家食品药品监督管理总局直接备案的事项。 5.下列补充申请不得与再注册同时申报: ⑴改换产地; ⑵增加药品规格。 6.申请人在申请进口药品再注册时所提交的药品标准资料应当包括企业内控标准。 (四)申请材料提交 申请人可通过窗口报送、邮寄等方式提交材料。 九、申请接收 (一)接收方式 1.窗口接收; 2.信函接收。 接收部门:国家食品药品监督管理总局行政受理服务大厅 接收地址:北京市西城区宣武门西大街28号大成广场3门一层 邮政编码:100053 联系电话:010—88331866 3.电子邮箱:slzx@sfda.gov.cn (二)对外办公时间:上午:9:00—11:30 下午:13:00—16:00 十、办理基本流程 符合申请再注册核档程序的:流程I
不符合再注册核档程序的:流程II
十一、办理方式 (一)受理: 申请人按照本《指南》第八条所列目录提交申请材料,向国家食品药品监督管理总局行政受理服务大厅提出申请,受理人员对申请材料进行形式审查。申请事项依法不需要取得行政许可的,即时告知申请人不受理;申请事项依法不属于本行政机关职权范围的,即时作出不予受理的决定,并告知申请人向有关行政机关申请;申请材料存在可以当场更正的错误的,允许申请人当场更正;申请材料不齐全或者不符合法定形式的,当场或者在5日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理;申请事项属于本行政机关职权范围,申请材料齐全、符合法定形式,或者申请人按照本行政机关的要求提交全部补正申请材料的,受理行政许可申请。 (二)药品注册检验(如需要): 受理后,国家食品药品监督管理总局通知中检院组织进行注册检验、确定审批或审评相关事项等工作。 (三)技术审评: 在药品注册检验的同时,受理人员将申请资料移送国家食品药品监督管理总局药品审评中心进行技术审评。 国家食品药品监督管理总局药品审评中心按照有关的技术审评原则完成技术审评。技术审评完成后,对于不符合技术审评要求需要补充资料的,申请人在4个月内补充资料,药品审评中心完成补充资料的审查。 进口药品再注册申请的核档工作由中检院承担。中检院在收到受理中心转交的进口药品再注册申请资料后,完成对该品种原始档案的核对工作,与再注册申请资料一并送国家食品药品监督管理总局药品化妆品注册管理司。 (四)行政许可决定: 在收到药品审评中心完成技术审评的资料后,国家食品药品监督管理总局在20日内作出许可决定。20日内不能作出决定的,经主管局领导批准,可以延长10日。 (五)送达: 自行政许可决定作出之日起10日内,CFDA受理和举报中心将行政许可决定送达申请人。 (六)复审: 申请人对国家食品药品监督管理总局作出的决定有异议的,在申请行政复议或者提起行政诉讼前,可以在收到决定之日起60日内填写《药品注册复审申请表》,向国家食品药品监督管理总局提出复审申请并说明复审理由。复审的内容仅限于原申请事项及原申报资料。 国家食品药品监督管理总局接到复审申请后,应当在50日内作出复审决定,并通知申请人。维持原决定的,国家食品药品监督管理总局不再受理再次的复审申请。 复审需要进行技术审查的,国家食品药品监督管理总局应当组织有关专业技术人员按照原申请时限进行。 十二、审批时限 1.受理:5个工作日; 2.行政许可决定:20个工作日(不含注册检验、技术审评和申请人补充资料及补充资料审评所需的时间)。20个工作日内不能做出决定的,经总局领导批准,可延长10个工作日。 十三、审批收费依据及标准 收费依据:财政部、国家发展改革委《关于重新发布中央管理的食品药品监督管理部门行政事业性收费项目的通知》(财税〔2015〕2号)和《关于印发〈药品、医疗器械产品注册收费标准管理办法〉的通知》(发改价格〔2015〕1006号) 收费标准:按照总局发布的《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告》(2015年第53号) 药品注册费标准 单位:万元
注:1.药品注册收费按一个原料药或一个制剂为一个品种计收,如再增加一种规格,则按相应类别增收20%注册费。 2.《药品注册管理办法》中属于省级食品药品监督管理部门备案或国务院食品药品监督管理部门直接备案的药品补充申请事项,不收取补充申请注册费,如此类申请经审核认为申请内容需要技术审评的,申请人应按照需要技术审评的补充申请的收费标准补交费用。 3.申请一次性进口药品的,收取药品注册费0.20万元。 4.进口药品注册收费标准在国内相应注册收费标准基础上加收国内外检查交通费、住宿费和伙食费等差额。 5.港、澳、台药品注册收费标准按进口药品注册收费标准执行。 6.药品注册加急费收费标准另行制定。 十四、审批结果 国家食品药品监督管理总局核发的药品批准文号、《进口药品注册证》的有效期为5年。有效期届满,需要继续生产或者进口的,申请人应当在有效期届满前6个月申请再注册。 许可年审或年检:无 十五、结果送达 国家食品药品监督管理总局应当自作出行政许可决定之日起10日内颁发、送达有关行政许可证件。 十六、申请人权利和义务 (一)依据《中华人民共和国行政许可法》,申请人依法享有以下权利: 1.依法取得行政许可的平等权利; 2.对行政机关实施行政许可,享有陈述权、申辩权; 3.依法申请行政复议或者提起行政诉讼; 4.合法权益因行政机关违法实施行政许可受到损害的,有权依法要求赔偿。 (二)依据《药品注册管理办法》(局令第28号)第一百五十五条和第一百五十六条,申请人依法享有以下权利: 1.药品监督管理部门依法作出不予受理或者不予批准的书面决定,应当说明理由,并告知申请人享有依法提请行政复议或者提起行政诉讼的权利。 2.申请人对国家食品药品监督管理局作出的不予批准决定有异议的,可以在收到不予批准的通知之日起60日内填写《药品注册复审申请表》,向国家食品药品监督管理局提出复审申请并说明复审理由。复审的内容仅限于原申请事项及原申报资料。 (三)依据《中华人民共和国行政许可法》,申请人依法履行以下义务: 1.对申请材料实质内容的真实性负责; 2.依法开展取得行政许可的活动 3.如实向负责监督检查的行政机关提供有关情况和材料。 (四)申请人应当按照《药品管理法》、《药品管理法实施条例》、《药品注册管理办法》的规定履行相应义务。 十七、咨询途径 (一)窗口咨询; (二)电话咨询; (三)电子邮件咨询; (四)信函咨询: 部门名称:国家食品药品监督管理总局行政受理服务大厅 通讯地址:北京市西城区宣武门西大街28号大成广场3门一层 邮政编码:100053 联系电话:(010)88331793 电子邮箱:slzx@sfda.gov.cn 十八、监督和投诉渠道 部门名称:国家食品药品监督管理总局行政事项受理服务和投诉举报中心 地址:北京市海淀区莲花池东路39号西金大厦七层 邮编:100036 电话:12331 十九、办公地址和时间 (一)办公地址:北京市西城区宣武门西大街28号大成广场3门一层 (二)对外办公时间:上午:9:00—11:30 下午:13:00—16:00 (三)乘车路线: 地铁:地铁2号线长椿街站D出口,往西799米即到。或地铁7号线广安门内站A出口,往北893米即到。 公交:乘坐56路,78路,395路,423路在槐柏树街西口下车,步行222米即到。乘坐42路,46路,49路,691路在天宁寺桥东下车,步行252米即到。乘坐26路,390路,395路,423路,456路,662路,691路在西便门下车,步行263米即到。 二十、公开查询 可通过网站http://www.sfda.gov.cn/WS01/CL0135/查询审批状态和结果。 (食品药品监督管理总局2016年05月05日发布) 扫一扫在手机打开当前页
|
|||||||||||||||||||||||||||||